EQUILÍBRIO QUÍMICO
O equilíbrio químico é um fenômeno que acontece nas reações químicas reversíveis entre reagentes e produtos.
Quando uma reação é direta, está transformando reagentes em produtos. Já quando ela ocorre de maneira inversa, os produtos estão transformando-se em reagentes.
Para ocorrer um equilíbrio químico é necessário que:
- a temperatura seja constante
- o sistema não tenha trocas com o ambiente
Quando um ponto de equilíbrio é atingido nas reações reversíveis tem-se:
- a velocidade das reações direta e inversa iguais.
- a concentração constante das substâncias presentes na reação.
O equilíbrio químico é medido por duas grandezas: a constante de equilíbrio e o grau de equilíbrio.
Ele pode ser alterado quando ocorre mudanças de: concentração, temperatura, pressão e uso de catalisadores.
Reações Químicas Reversíveis
Exemplo de equação química:
H2 + 1/2 O2 ------> H2O
No primeiro membro (antes da seta) aparecem os reagentes, ou seja, as substâncias que entram na reação.
No segundo membro (depois da seta) estão os produtos, isto é, as substâncias que foram formadas pela reação.
Em uma reação reversível ela pode ocorrer nos dois sentidos.
Assim, nas reações diretas os reagentes formam produtos (reagentes → produtos). Já nas reações inversas, os produtos formam reagentes (produtos → reagentes). ( https://www.todamateria.com.br/)
mais em: https://x-xquimica.com.br/equilibrios-quimicos-definicoes-e-deslocamento/
 |
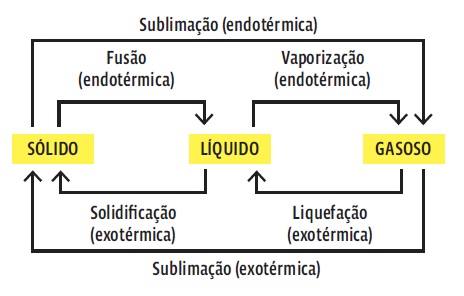
| EQUILÍBRIO - GOOGLE IMAGES |








.jpg)