TUDO BEM?
Quando se fala em teoria dos orbitais, há sempre dúvidas surgindo, mesmo porque essas teorias necessitam de vários conhecimentos para entende-las, como são apresentadas.
Vamos tentar explicar, sem complicar!
Primeiro você precisa saber que quando os orbitais atômicos se unem, formam os orbitais moleculares.
E o que são orbitais?
Lembra do princípio de Incerteza de Heisenberg?
Ele diz que não se pode determinar, com certeza onde um elétron está, pois não tem como identificar sua posição e sua velocidade ao mesmo tempo.( são muito rápidos!)
Logo, criou-se o conceito de regiões de probabilidade: são os orbitais!
Os orbitais estão nas camadas eletrônicas ( K,L,M,N,O,P,Q) e são regiões de probabilidade de se encontrar os elétrons.
Mas, atenção: cada orbital tem um número máximo de elétrons determinado.
assim:
Orbital S tem 2 elétrons
Orbital P tem 6 elétrons
Orbital D tem 10 elétrons
Orbital F tem 14 elétrons
E a forma desses orbitais?
Vamos lá:
ORBITAIS S :

ORBITAIS P:
CONJUNTO DOS ORBITAIS P :
ORBITAIS D :
ORBITAIS F:
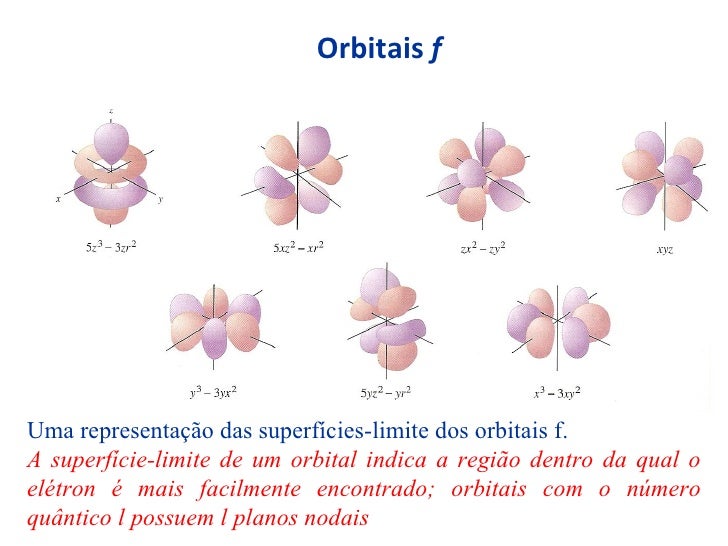
Agora que você já conhece os orbitais atômicos, vamos ver de que forma eles se ligam!
Nenhum comentário:
Postar um comentário